«Después de muchos días y noches de increíble trabajo y cansancio, conseguí descubrir la causa […] de la vida. Es más: había conseguido ser capaz de infundir vida en la materia muerta.».
—Frankenstein o el Moderno Prometeo, Mary Shelley (1818)
En 2018 celebraremos 200 años de la primera edición de Frankenstein o el Moderno Prometeo, fruto del genio y creatividad de una joven Mary Shelley [1]. En su libro, influenciada por los experimentos de electrofisiología de Galvani y Volta, sugirió la posibilidad de dotar a la materia muerta de “calor vital” o “chispa de la vida”, creando así el mito de Frankenstein que conocemos hoy.
Muchos han intentado encontrar propiedades vitales en la materia inerte. Los componentes de los seres vivos no son diferentes de aquellos en seres inanimados, sin embargo, tienen propiedades que nos permiten clasificarlos como tales. Por ejemplo, los seres vivos se autoorganizan, crecen y se reproducen en constante interacción termodinámica con su entorno. Y, ante todo, se mueven. El “movimiento con propósito”, ya sea para crecer, transportar nutrientes o responder a estímulos, es algo que desde Aristóteles atribuimos a seres “animados”. Cuando el botánico Robert Brown observó por primera vez en un microscopio el movimiento errático de partículas de polen flotando en el agua, creyó que esta actividad se debía a una “fuerza vital” [2]. La explicación que dio Einstein de las observaciones de Brown (hoy conocido como movimiento Browniano) acabó con la concepción vitalista de que el movimiento aleatorio era una propiedad exclusiva de los seres vivos e identificó correctamente su origen en el calor [3]. Por ejemplo, gracias a este movimiento térmico, las partículas del aire que respiras alcanzan las velocidades de un avión (aunque éstas no llegan muy lejos porque colisionan entre sí constantemente). Y lo hacen sin gastar energía, ¡gratis!
Aunque no todo lo que se mueva esté vivo, aún puede ser materia activa si se mueve de manera autónoma y consumiendo energía. Una piedra no es activa. Las partículas de polen de Brown se difunden en el agua, pero no son activas. Pero una bacteria es materia activa. Un nuevo campo que une las ciencias biológicas y físicas ha surgido en los últimos años que estudia la materia activa. Los sistemas activos decimos que permanecen fuera del equilibrio termodinámico, consumiendo energía del entorno (o almacenada internamente) para moverse. Lejos del aburrido equilibrio termodinámico (el equilibrio es un estado donde no hay cambio, ni flujos de masa o energía), las partículas activas interaccionan entre sí y forman nuevos fenómenos colectivos que todavía no alcanzamos a entender. Estamos rodeados de materia activa, desde las bandadas de pájaros, bancos de peces o colonias de bacterias a humanos. Una de las características más interesantes de los materiales activos es que muestran propiedades emergentes inesperadas cuando consumen energía y esto ocurre a todas las escalas de longitud, e.g. pájaros sin líder se sincronizan en el cielo creando una bandada, el citoesqueleto se autoorganiza en complejas estructuras dentro de la célula.
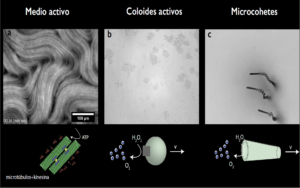
El estudio de la materia activa ha salido del ámbito de la biología y se han empezado a crear versiones sintéticas en el laboratorio, usando tanto componentes biológicos como artificiales. Un ejemplo pionero de materia activa sintética consiste en usar los constituyentes del citosesqueleto (literalmente » esqueleto de la célula»), llamados microtúbulos y unirlos con motores moleculares para formar un medio activo y encapsularlo en una vesícula [4]. Tras suministrar un combustible molecular llamado trifosfato de adenosina (ATP), los microtúbulos se pliegan, doblan, propulsan y forman patrones espontáneos como en la Figura 1. a.
Las micropartículas químicamente activas son otra clase importante de materia activa. Estas partículas sintéticas logran autopropulsarse a través de una reacción catalítica de un combustible en su entorno. Un ejemplo notable (Figura 1.b), desarrollado en la universidad de Nueva York (NYU), consiste en la creación de partículas asimétricas de hematita, un mineral de óxido de hierro, encapsuladas dentro de un polímero esférico (el nombre de estas partículas es Janus, como el Dios romano de dos caras) [5]. En presencia de un combustible y algo de luz, estas partículas catalizan una reacción que hace que se muevan espontáneamente formando grupos de partículas como si fueran bandadas de pájaros. Sin combustible ni luz, las partículas cesan su actividad y se desagrupan. Estas “partículas vivas” han abierto un nuevo campo de investigación en las ciencias de materiales y han inspirado muchos otros tipos de partículas “nadadoras”, como los microcohetes de la Figura 1.c [6].
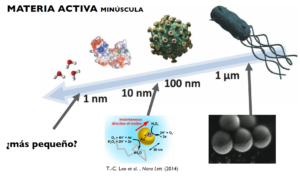
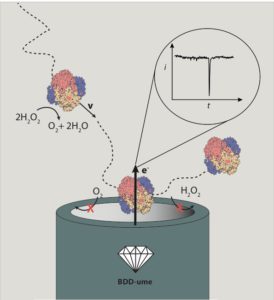
¿Pero cuán pequeñas pueden ser las partículas autopropulsadas? ¿Y cómo podemos observarlas en la nanoescala? Estas son preguntas todavía sin responder. Hasta la fecha, la comunidad científica ha podido crear nanomotores sintéticos de varias decenas de nanómetros (el grosor de un cabello es aproximadamente 100.000 nanómetros). En nuestro laboratorio hemos desarrollado nuevos métodos para conseguir nanomotores aún más pequeños (Figura 2). También hay enzimas que manifiestan propiedades de autopropulsión, como la catalasa y la ureasa. Los nanomotores metálicos y enzimáticos son ejemplos de materia activa en la nanoescala y medimos su movilidad a través de microscopia de fluorescencia o más recientemente usando pequeños electrodos (Figura 3) [6]. La materia activa en la nanoescala tiene aplicaciones potenciales en el transporte activo de nanopartículas, por ejemplo, para transportar medicamentos en nanomedicina. Los nanomotores autopropulsados pueden dar una nueva visión sobre la locomoción y autoorganización de los seres vivos y ayudarnos a encontrar nuevas formas de convertir energía en movimiento. A medida que más investigadores se adentren en la física de la materia activa, seremos capaces de descubrir nuevas leyes que determinan el comportamiento de estos sistemas y, quién sabe, quizás estaremos más cerca del sueño de Shelley de dar a la materia la chispa de la vida.
By Dr. Ibón Santiago. Investigador postdoctoral en la Universidad de Oxford. Delegación de Oxford.
Más información:
Webpage: https://www2.physics.ox.ac.uk/contacts/people/santiago
[1] M. Shelley, Frankenstein: Annotated for Scientists, Engineers, and Creators of All Kinds -MIT Press (2017).
–Acceso gratuito aquí
-Global Frankenstein Bicentennial Project (aquí)
[2] R. Brown, A Brief Account of Microscopical Observations … on the Particles Contained in the Pollen of Plants; and on the General Existence of Active Molecules in Organic and Inorganic Bodies. 1828. Acceso aquí
[3] A. Einstein, “On the motion of small particles suspended in liquids at rest required by the molecular-kinetic theory of heat”, Annalen Der Physik 17 (1905). Acceso aquí
.
[4] T. Sanchez, D. T. N. Chen, S. J. DeCamp, M. Heymann, and Z. Dogic, “Spontaneous motion in hierarchically assembled active matter,” Nature, vol. 491, no. 7424, pp. 431–+, 2012. Acceso aquí
[5] J. Palacci, S. Sacanna, A. P. Steinberg, D. J. Pine, and P. M. Chaikin, “Living Crystals of Light-Activated Colloidal Surfers,” Science, vol. 339, no. 6122, pp. 936–940, 2013. Acceso aquí
[6] Li, Jinxing, Isaac Rozen, and Joseph Wang. «Rocket science at the nanoscale.» ACS nano 10.6 (2016): 5619-5634. Acceso aquí
[7] L. Jiang*, I. Santiago*, and J. Foord, “Observation of nanoimpact events of catalase on diamond ultramicroelectrodes by direct electron transfer,” Chem. Commun., vol. 53, no. 59, pp. 8332–8335, Jul. 2017. Acceso aquí