Ya decía Led Zeppelin en 1969 aquello de:
“Heartbreaker, your time has come. Can't take your evil way. Go away heartbreaker”
Como sabéis no podemos basarnos en la lírica para llevar a cabo nuestras investigaciones. Sin embargo, como muchos habríamos optado por el camino de las musas si nos hubieran elegido, en su caso intentamos añadir un toque artístico a nuestro trabajo. Así, y casualmente, un año después de publicar esta canción, se aprobó el protocolo para disponer del primer dispositivo de imagen de resonancia magnética. Fue en parte en este protocolo en el cual Godfrey Newbold Hounsfield se basó para crear el primer tomógrafo, llevándolo a recibir el Premio Nobel de Fisiología en 1979 [1]. . La importancia de este premio radicó en lo que hoy llamamos equipos de investigación multidisciplinares, haciendo por tanto que un premio de base médica acabara en manos de un ingeniero electrónico. De esta forma, 50 años después me he permitido cerrar el ciclo valiéndome de los conocimientos aportados por Hounsfield para intentar dar explicación a los cambios anatómicos y fisiológicos que sufre nuestro sistema cardíaco frente a ese temido “evil heartbreaker”.
Si ante un juego mental rápido le pides a la otra persona que piense en un corazón, la imagen que seguro le viene rápidamente a la cabeza es la de un emoticono; lo que no sabe este es que probablemente esa imagen es la de un corazón hipertrofiado, es decir, un corazón que muestra un crecimiento anormal que suele asociarse a algunas patologías como la diabetes u obesidad. Mediante la colaboración de mi grupo de investigación de origen (IP-Dr. Andrés Hueva) y el grupo que me acogió para realizar mi estancia del programa “On the Move” (SRUK/CERU) durante el 2020 (IP-Dr. Pablo Lamata), conseguimos enlazar los conocimientos de biología molecular (Laboratorio-Dr. Antonio Andrés) previos con los amplios usos de la imagen cardiaca (Laboratorio-Dr. Pablo Lamata), buscando una posible salida a este fenómeno.
Anteriores trabajos realizados en el laboratorio nos llevaron a reflexionar sobre el papel de la leptina como posible inductor de cambios en el corazón. La leptina [2], una hormona producida en nuestro tejido graso, es capaz de moverse a través del flujo sanguíneo y llegar al hipotálamo. En este punto interacciona con receptores específicos para la hormona provocando la activación del sistema nervioso simpático, que va a transmitir la información central hasta los órganos periféricos como el corazón, el hígado o el tejido adiposo.
Después de estudiar un entramado de vías metabólicas (reacciones químicas que permiten producir y consumir energía y metabolitos fundamentales para el funcionamiento celular) e inflamatorias (vías de activación de la respuesta inmunitaria inflamatoria en respuesta a un estímulo) después de un tratamiento central y crónico con leptina [3], llegamos a la conclusión de que estas parecían estar interconectadas, de manera que nuestro tratamiento estaba favoreciendo que esa imagen reflejo del emoticono pasara a reducir su tamaño. Pero ¿cómo nos podíamos asegurar de que ese concepto era real? Aquí es donde entra en juego CERU (SRUK) y su programa de movilidad “On the move”. Sin pensarlo dos veces, contacté con el grupo del Dr. Pablo Lamata de la School of Biomedical Engineering and Imaging Sciences (King’s College London). Había leído parte de su trabajo sobre modelos predictivos “in silico” (computacionales) de hipertrofia cardiaca y aunque me pillaba algo lejos volví a pensar que para algo se habían creado los equipos multidisciplinares (Hounsfield, de nuevo y la investigación multidisciplinar). Así, pudimos pasar de esa imagen mental a la que antes hacíamos referencia a la siguiente:
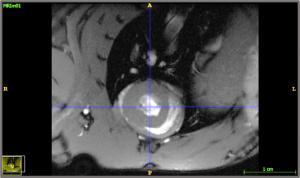
Esta imagen no es más que una RMN que se vale de un potente campo magnético, de las ondas de radio y un ordenador para producir imágenes detalladas de diferentes estructuras corporales internas. En este caso tenemos una imagen que se obtiene al trazar un plano perpendicular a la base del corazón, de manera que el órgano adquiere una posición en forma de anillo. Este tipo de cortes nos permite estudiar los cambios morfológicos asociados a nuestro tratamiento, así como diversos parámetros fisiológicos. Todo ello en definitiva, nos da una forma de interpretar nuestro modelo, concluyendo en nuestro caso que la leptina central, a las dosis y tiempos establecidos para el estudio, no favorece un crecimiento excesivo o anormal de las paredes del corazón, al que llamamos hipertrofia.
Por último, nos parecía necesario contribuir con algo más en relación al efecto de la leptina en el corazón. Por ello, decidimos generar un modelo “in silico” del corazón de nuestras ratas para estudiar el comportamiento de este órgano bajo varios modelos computacionales que usan diferentes algoritmos. De esta forma, una vez encontremos el modelo computacional que mejor explica el comportamiento del corazón de las ratas bajo el efecto de la leptina, podremos utilizarlo para predecir de una manera más exacta y precisa el desarrollo de la hipertrofia cardiaca. Idealmente, estas predicciones podrían ratificar los datos previos obtenidos a nivel experimental, lo cual acabaría validando (o no) nuestra hipótesis inicial: la leptina a nivel central facilita la atrofia (concepto opuesto a hipertrofia) en el corazón.
Desafortunadamente, los tiempos en ciencia difieren mucho de lo esperado, de manera que cuando se dice “hemos decidido” en verdad significa que espero poder hablaros más de ello en una no muy lejana entrega del blog.
* * *
Por Blanca María Rubio Muñoz, Dra. Ciencias de la Salud. Profesora asociada de la Facultad de Ciencias Ambientales y Bioquímica de la Universidad de Castilla-La Mancha.
Más información: