En los últimos 40 años, la supervivencia al cáncer se ha duplicado gracias a mejoras en la detección, terapia y cuidados de apoyo [1,2]. De hecho, aproximadamente un 50% de los pacientes diagnosticados de cáncer sobreviven durante 10 o más años, y esta tasa de supervivencia sigue aumentando cada año [3]. Pero entonces… ¿qué ocurre tras superar el cáncer?
Una de las mayores preocupaciones es conservar la fertilidad: las terapias contra el cáncer pueden ser muy tóxicas para los ovarios, y los tratamientos pueden desembocar en problemas reproductivos, como la infertilidad y la insuficiencia ovárica prematura (cuando los ovarios dejan de funcionar con normalidad antes de los 40 años).
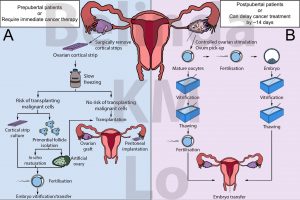
Para las mujeres adultas que tienen la posibilidad de retrasar su terapia, la congelación de óvulos o embriones puede ser una opción (Figura 1B). Esto supone una estimulación hormonal controlada de los ovarios para producir óvulos. Estos óvulos se pueden extraer para ser congelados directamente, o se pueden fertilizar con espermatozoides, y congelar y almacenar el embrión resultante. Tras el tratamiento contra el cáncer, los óvulos se pueden descongelar y fertilizar para generar embriones. En el caso de los embriones congelados, se pueden transferir directamente a la paciente. Desde 2012, la Sociedad Americana de Medicina Reproductiva acepta la congelación de óvulos como tratamiento de fertilidad [4]. Además, varios ensayos clínicos han demostrado que las tasas de embarazo a partir de óvulos congelados son comparables a usar óvulos frescos [5,6].
Sin embargo, congelar óvulos y embriones puede no ser posible para todas las pacientes, como aquellas con cánceres sensibles a hormonas, las que requieren un tratamiento inmediato, o pacientes prepuberales que no responden a la estimulación de los ovarios (Figura 1A). Con cada vez más pacientes prepuberales llegando a una edad fértil [1], es necesario considerar las opciones para asegurar su futura fertilidad antes de someterse a un tratamiento contra el cáncer.
La criopreservación de tejido ovárico ofrece un método para conservar la fertilidad de estas pacientes sin necesidad de estimulación hormonal. Su objetivo es congelar tiras de corteza ovárica (inmediatamente por debajo de la superficie del ovario), que contiene un gran número de folículos primordiales, la unidad básica de fertilidad del ovario. Cada folículo primordial tiene el potencial de crecer y generar un óvulo.
Tras el tratamiento contra el cáncer, estas muestras congeladas de tejido ovárico se pueden descongelar y trasplantar a la paciente para restablecer la función de los ovarios. Algunas mujeres experimentan una recuperación de la función ovárica durante hasta 10 años [7]. De hecho, se estima que 130 niños han sido concebidos en todo el mundo como resultado del trasplante de tejido ovárico [8,9,10].
A pesar de los beneficios de la criopreservación y trasplante de tejido ovárico, se estima que la mayoría de los folículos se pierden durante el proceso, concretamente cuando el tejido trasplantado vuelve a desarrollar un suministro de sangre y oxígeno. Además, el trasplante de tejido ovárico después de la terapia contra el cáncer puede reintroducir células cancerosas. Esto es de particular importancia en cánceres con un alto riesgo de metástasis en los ovarios (por ejemplo, leucemia, neuroblastoma o linfoma de Burkitt) [11].
El riesgo de reintroducción del cáncer se puede evitar desarrollando óvulos fertilizables a partir de ovarios artificiales. Un ovario artificial es un tejido que contiene una mezcla de células ováricas creada para simular la fisiología de un ovario. Estos ovarios artificiales también pueden incluir un andamiaje para sostener las células en una estructura tridimensional, así como proporcionar factores adicionales para mejorar la función del ovario. Una vez generados, estos ovarios artificiales pueden ser trasplantados o cultivados in vitro para desarrollar óvulos fertilizables (Figura 1A).
Usando tejidos de pacientes de cáncer, distintos grupos de investigación están demostrando las aplicaciones potenciales de los ovarios artificiales. Se han aislado folículos de tejidos ováricos de pacientes con leucemia sin células cancerosas detectables [12]. Las células ováricas de soporte, que proporcionan factores de crecimiento al folículo, pueden ser potencialmente aisladas de los ovarios de la misma paciente tras el tratamiento contra el cáncer, para evitar la reintroducción de éste [13].
La creación de ovarios artificiales está aún en fase experimental, pero la supervivencia folicular se ha demostrado en un ovario artificial humano que fue trasplantado a un ratón durante tres semanas [14]. Futuros trabajos podrían incluso investigar las células madre ováricas e inducir células pluripotentes (un tipo de célula madre, generada a partir de células maduras, que puede convertirse en cualquier tipo de célula humana que sea necesario) como fuente de células germinales, especialmente para pacientes que no pueden no tener suficientes folículos en sus ovarios. Usando células pluripotentes inducidas derivadas de células adultas en ratones, un grupo japonés fue capaz de obtener óvulos fertilizables in vitro, resultando en el nacimiento de once crías sanas.
Aunque el énfasis está en las pacientes de cáncer, las tecnologías aquí mencionadas pueden ser también aplicables a otras mujeres que requieran preservar su fertilidad, y a restablecer la función de los ovarios más allá de la fertilidad, por ejemplo durante la menopausia.
* * *
Por Dr. Belinda Lo (@belinda_lo), embrióloga en el Sanatorio y Hospital de Hong Kong. DPhil en Obstetricia y Ginecología por la Universidad de Oxford.
Más información:
- Cancer Research UK. Estadísticas de cáncer en Reino Unido, 2015.
- Ferlay, J. et al. (2015).
- Guzzinati, S. et al. (2018).
- Comité de práctica de la Sociedad Americana en Medicina Reproductiva (2012).
- Cobo, A. et al. (2010).
- Rienzi, L. et al. (2010).
- Andersen, C. Y et al. (2012).
- Donnez, J. & Dolmans, M. M. (2017).
- Gellert, S. E. et al. (2018).
- Jensen, A. K. et al. (2017).
- Dolmans, M. M. et al. (2013).
- Soares, M. et al. (2017).
- Andersen, C.Y. et al. (2019).
- Pors, S. E. et al. (2019).
Imagen de portada:
Introduciendo tiras de tejido ovárico en una solución líquida donde ser preservados, Dr. Vereczkey Attila. Fuente: Wikimedia.