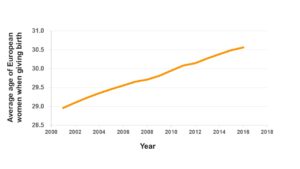
En los últimos años ha habido grandes cambios en las aspiraciones y actividades de la mujer. Cada vez más mujeres buscan consolidar su carrera profesional y conseguir una cierta estabilidad laboral antes de tener un hijo. Ésto, sumado a un mayor acceso a métodos de planificación familiar, ha hecho que la edad media de las mujeres que dan a luz en Europa se haya retrasado bastante, como puedes ver en el gráfico de abajo (fig. 1) [1]. El problema que radica de este cambio social es, básicamente, una mayor dificultad para la concepción. Vamos, que se nos complica eso de ser madres.
Conforme envejecemos, las posibilidades de embarazo disminuyen. Las mujeres nacemos con alrededor de un millón de ovocitos, que son las células que luego se transforman en óvulos. Este número se va reduciendo antes de la pubertad, hasta quedar en unos 400.000. Ésta sería la reserva ovárica. Parece que tenemos muchas probabilidades de que uno de ese casi medio millón de ovocitos forme un bebé, ¿verdad? Pero de ellos, sólo un 1% llega a transformarse en un óvulo maduro, listo para ser fertilizado. Por si esto fuera poco, la calidad de los óvulos es cada vez menor. Por eso, a partir de los 35 años, el potencial reproductivo disminuye significativamente y después de los 40 años la posibilidad de embarazo está entre un 10 y un 30%, según los expertos [2].
Bueno, bueno, que no cunda el pánico. Gracias a la reproducción asistida es posible tener descendencia biológica y vida laboral sin necesidad de reencarnación, mediante una técnica llamada criopreservación de óvulos. Es decir, una mujer que planea ser madre después de los 35, puede congelar sus propios óvulos hasta que decida usarlos. Pero ¿qué pasa si no tiene las cosas tan claras a los 25? ¿y si el deseo de ser madre llega por sorpresa? ¿o si la infertilidad llega a edades muy tempranas, por tratamientos como la quimioterapia o por un fallo ovárico prematuro?
En estos casos, la alternativa podría ser recurrir a óvulos donados. El problema es que la donación de óvulos requiere un previo tratamiento con hormonas y un pequeño proceso quirúrgico, llamado punción folicular, para recoger el óvulo justo cuando sale del ovario. Ello supone, como mínimo, una molestia a la mujer, por lo que encontrar donantes de óvulos no es tan fácil como encontrar donantes de esperma. Como te puedes imaginar, esto es una limitación importante de la reproducción asistida. Afortunadamente, la ciencia podría encontrar una solución. Existen, al menos, dos ramas de estudio que merecen una mención en este post. Vamos por pasos.
Imagina que sólo tuvieras que ir al médico, dejar una muestra de saliva con células de la mejilla y pedir que las transformaran en óvulos. Fácil ¿verdad? Sin lista de espera, sin dolor, sin tratamientos hormonales previos. Simplemente, tratarían esas células de la piel para que se transformen. Puede que suene a ciencia ficción, pero no lo es. Se llama reprogramación celular y ya se ha realizado en células humanas [3]. La reprogramación celular consiste en la transformación de una célula que ya está especializada en otro tipo celular diferente. Para ello, primero hay que hacer que las células olviden qué tipo de células son o desdiferenciarlas. Se sabe que esto es posible utilizando unas proteínas que controlan la expresión de los genes claves en el proceso. Estas células desdiferenciadas pueden transformarse en muchos tipos diferentes de células. Para rediferenciarlas específicamente en ovocitos habría que proporcionarles en el laboratorio unas condiciones similares a las que permiten la formación de ovocitos en el propio ovario (fig. 2a).
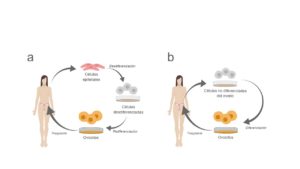
La otra alternativa tiene algo que ver con la reserva ovárica que mencionamos anteriormente. ¿Recuerdas que constaba de unos 400.000 óvulos que se iban gastando en cada menstruación? Hace unos años se pensaba que esta reserva no podía regenerarse, que una mujer contaba con un número fijo de células precursoras de óvulos. En cambio, se sabía que las células de la sangre se regeneran en el cuerpo humano de forma natural. Es decir, en nuestro cuerpo existen unas llamadas células madre que pueden ganar las características de células especializadas. Sí, como si ya estuvieran desdiferenciadas. Pues bien, se ha descubierto que también existen células madre en el ovario de ratón y que si se cultivan in vitro pueden diferenciarse y madurar hasta llegar a ser ovocitos (fig. 2b). Estos pueden volver a transplantarse al ovario de una y, de hecho, ya han nacido ratoncitos sanos a partir de ellos en ratonas que antes del transplante eran estériles . La buena noticia es que también en humanos se han encontrado este tipo de células [4].
La verdad es que todo esto queda un poco lejos de las técnicas que los médicos nos pueden ofrecer hoy en día en una clínica de reproducción asistida, igual que los concesionarios no nos ofrecen coches voladores –si te ofrecen alguno, yo no me fiaría un pelo. Aún hay muchas preguntas en el aire acerca de cómo las células se diferencian (y desdiferencian), cómo se pueden aplicar estos conocimientos a la reproducción humana, qué efectos pueden tener las técnicas mencionadas en la descendencia generada a partir de ellas y cuál sería el coste de estos tratamientos. Además, es necesario realizar un profundo análisis ético que lidie con la controversia que ello pueda generar, porque no estamos hablando de tortillas de patatas, estamos hablando de personas.
Lo que está claro es que la ciencia avanza a pasos agigantados y que podría acabar con los límites actuales de la medicina reproductiva. Todo sea por hacer más fácil la adaptación de las familias al nuevo rol de las mujeres en la sociedad.
Referencias
[1] Eurostat
[2] Instituto Valenciano de la Infertilidad
[3] Takahashi, K. & Yamanaka, S. Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors. Cell 126, 663–676 (2006).
[4] Carroll, J., Whittingham, D. G., Wood, M. J., Telfer, E., & Gosden, R. G. Extra-ovarian production of mature viable mouse oocytes from frozen primary follicles. Journal of Reproduction and Fertility, 90(1), 321-327 (1990).
Por Ana I Rodríguez Rodríguez. Estudiante de doctorado en el Wellcome Trust Centre for Cell Biology. University of Edinburgh. Delegación de CERU en Escocia.