¿Cuántas veces ha soñado la humanidad con una cura universal para el cáncer? Según la Organización Mundial de la Salud (OMS), el cáncer es la segunda principal causa de muerte en el mundo, solamente superado por las enfermedades cardiovasculares. Además, en 2020 causó alrededor de 10 millones de muertes [1]. A día de hoy, es común tener a un conocido, familiar o amigo que está sufriendo o ha sufrido esta enfermedad que causa tanto dolor tanto a los pacientes como a sus seres queridos. Por eso, una cura total para el cáncer es poco menos que el Santo Grial de la medicina humana. Desafortunadamente, dadas las diferencias clave que existen entre diferentes tumores a nivel biológico y molecular, es muy poco probable que un remedio tal exista. Sin embargo, lo que sí que se puede hacer con los advances tecnológicos y científicos actualmente es identificar los puntos débiles y las vulnerabilidades comunes en varios tumores e intentar aprovecharlos a nuestro favor.
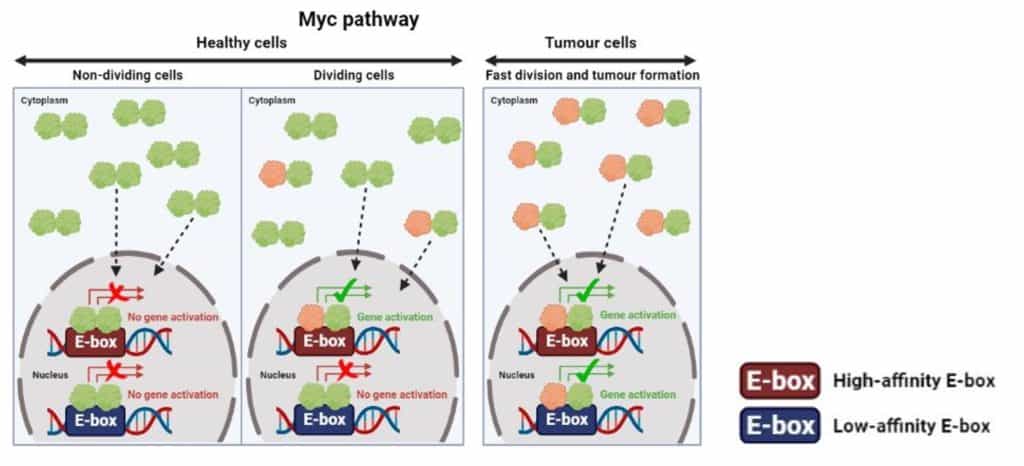
Uno de los mecanismos celulares asociados con el cáncer más investigado hasta el momento es la vía que incluye a la proteína Myc. Esta proteína opera como una coordinadora central de la proliferación de las células de nuestro cuerpo y se encuentra en niveles excesivamente altos en aproximadamente el 70% de los tumores [2]. En la célula, la función de Myc depende de su unión física a la proteína Max, lo cual da lugar a la formación de lo que conocemos como dímero proteico: el dímero Myc-Max. Cuando esta interacción se produce, el dímero Myc-Max es internalizado en el núcleo celular (donde se encuentra el ADN), siendo éste el lugar donde este dímero se une a ciertas regiones del genoma conocidas como E-boxes. El resultado de este evento es la activación de genes que llevarán a cabo la división celular (mitosis). En otras palabras, la actividad conjunta de Myc y Max como dímero dicta cuándo las células están preparadas para dividirse, lo que resulta en la activación de la maquinaria celular necesaria para iniciar este proceso. Max es estructuralmente muy parecida a Myc, aunque carece de una región activa que Myc tiene. Consecuentemente, Max no puede activar la expresión de genes por sí sola.
En una célula sana, la cantidad de Myc en la célula está rigurosamente regulada para que se encuentre a niveles fisiológicos (saludables). En este contexto, la proteína Max se une a ella misma de forma predominante, formando dímeros inactivos Max-Max. A su vez, es importante señalar que solo una cantidad pequeña y transitoria de dímeros Myc-Max pueden unirse a las E-boxes del ADN de forma eficaz, lo cual es suficiente para el correcto funcionamiento celular. No obstante, en células cancerosas, Myc aumenta excepcionalmente su presencia y actividad, incrementando así la proporción de dímeros Myc-Max respecto a la de dímeros Max-Max. Esto significa que hay más dímeros Myc-Max activos uniéndose a las E-boxes, lo cual desencadena una cascada de eventos en la célula que acaba causando cambios profundos en su comportamiento. Primordialmente, estas nuevas señales fomentan el crecimiento tumoral, aumentando así el potencial de formar metástasis, la resistencia a tratamientos, el transporte de nutrientes hacia el tumor, la protección del tumor al ataque del sistema inmune, etc. [3].
Como consecuencia, muchos investigadores han centrado sus esfuerzos durante décadas en la búsqueda de una estrategia para la inhibición de Myc con la intención de contrarrestar el crecimiento y progresión tumoral. De este modo, Myc se ha convertido en la diana terapéutica más deseada para tratar el cáncer. Sin embargo, debido a ciertas características de esta proteína, siempre ha habido varios debates que se centran en la imposibilidad de intervenir sobre Myc. Estas creencias giran entorno a varias hipótesis: (i) posibles graves efectos secundarios en células sanas si Myc se inhibe, (ii) la dificultad de diseñar fármacos funcionales debido a la ausencia de sitios de unión en la estructura de Myc (iii) o el reto que supone inhibir una proteína que se encuentra en el núcleo celular, lo cual dificulta el acceso de la mayoría de fármacos debido a la alta compartimentalización en esta región de la célula [4].
Entre el personal investigador intentando desmontar este mito está la Dra. Laura Soucek, la jefa del grupo de investigación de «Modelización de Terapias Antitumorales» en el VHIO en Barcelona. La Dra. Soucek también es profesora investigadora ICREA desde 2014 y cofundadora y CEO de Peptomyc S.L, una compañía focalizada en el desarrollo de un inhibidor de Myc llamado Omomyc [5]. Este inhibidor podría ser el primer fármaco de su clase en ser comercializado si los resultados en los ensayos clínicos son positivos.
Omomyc es una ‘miniproteína’ inicialmente desarrollada en 1998 con la intención de imitar a la proteína Myc, aunque presenta propiedades adicionales. Para conseguirlo, Omomyc se creó simulando una fracción modificada de la proteína Myc para así potenciar su capacidad de unión a otras proteínas [6]. Sin embargo, al igual que Max, Omomyc carece de la región activa. Mientras que la proteína Myc no puede formar dímeros Myc-Myc, Omomyc puede unirse tanto a sí mismo, a Max o a Myc. De este modo, se acaban generando dímeros Omomyc-Omomyc, Omomyc-Max y Omomyc-Myc. Dos de estos dímeros (Omomyc-Omomyc y Omomyc-Max) pueden bloquear la activación de los genes pro-tumorales y suprimir el crecimiento de células tumorales, las cuales morirán. Por otro lado, el dímero Omomyc-Myc dirige la proteína Myc a ser eliminada [7].
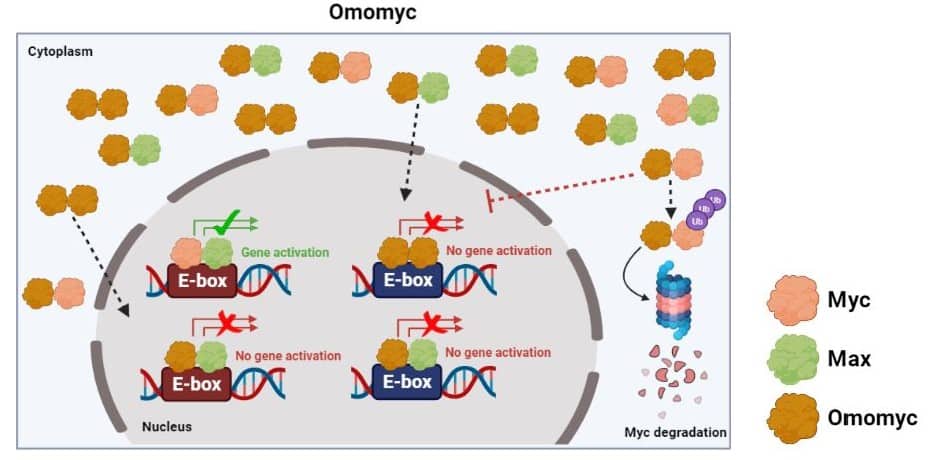
Los resultados preclínicos de Omomyc son esperanzadores, ya que sugieren una correcta absorción por parte de las células y una alta eficacia en múltiples modelos animales, tanto en tumores primarios (los primeros en originarse) como en metástasis [9, 10]. A día de hoy, hay ensayos clínicos multicéntricos de fase I y II (OMO-103) en marcha en Barcelona (Hospital Universitari Vall d’Hebron) y en Madrid (Hospital Universitario H.M Sanchinarro y Hospital Universitario Fundación Jiménez Díaz) para evaluar la seguridad de Omomyc. Los pacientes registrados en este ensayo son pacientes con cáncer en fase avanzada, incluyendo cáncer de pulmón, mama y colorrectal, los cuales no responden a otras terapias [11]. Será interesante ver, en los próximos años, cuál es el recorrido de Omomyc en posibles futuras fases del desarrollo clínico.
A pesar de todos estos avances, incluso en el hipotético caso de que algunos pacientes tratados con Omomyc experimentaran una desaparición completa de la enfermedad, Omomyc no se convertiría en una cura universal para el cáncer. De hecho, lo más probable es que nunca llegue a existir algo así. Los avances en biología molecular durante las últimas décadas han derivado en un mejor conocimiento sobre el cáncer y su biología, así como también sobre qué moléculas, proteínas y vías celulares son relevantes para el crecimiento tumoral. Ahora, podemos poner en práctica lo que hemos aprendido para diseñar fármacos que actúen directamente sobre estos elementos tumorales, como en el caso de Omomyc. Otro ejemplo es el del fármaco Trastuzumab, el cual se aprobó para el tratamiento de cáncer HER2+ gástrico y de mama, tanto metastático como no metastático. Éstos son solo dos ejemplos entre los muchos fármacos similares que se han sintetizado durante los últimos años con aplicaciones relacionadas [12].
Avances como los de Omomyc ilustran el potencial que la próxima generación de fármacos puede tener para tratar el cáncer, los cuales han sido desarrollados a partir del extenso estudio de muestras tumorales para el descubrimiento de terapias dirigidas. Omomyc no es solo una luz de esperanza para pacientes de cáncer, sino también para los muchos investigadores que están actualmente trabajando en diferentes métodos para inhibir Myc como posible terapia contra el cáncer.
Por Enric Arasanz Picher (@EnricArasanz), estudiante de doctorado en la Universidad de Bradford (Institute of Cancer Therapeutics).
Más información:
- [Recurso disponible en Inglés] Cancer. Fuente: Wolrd Health Organisation (WHO), 2022. Disponible online aquí.
- Dang CV, 2012.
- Whitfield JR and Soucek L, 2021.
- Massó-Vallés D and Soucek L, 2020.
- Soucek L et al., 2002.
- Soucek L et al., 1998.
- Jung LA et al., 2017.
- Demma MJ et al., 2019.
- Beaulieu ME et al., 2019.
- Massó-Vallés D et al., 2022.
- [Recurso disponible en Inglés] Phase 1/2 Study to Evaluate Safety, PK and Efficacy of the MYC-Inhibitor OMO-103 in Solid Tumours (MYCure). Fuente: ClinicalTrials.gov. Disponible online aquí.
- Sawyers CL, 2019.