Si mi amiga Laura hubiera nacido en la antigua Grecia, habría sido alquimista. Me la imagino con una túnica blanca recitando hechizos varios y mezclando líquidos viscosos para conseguir fabricar oro o encontrar el elixir de la vida eterna. La alquimia empezó entonces, o tal vez muchos siglos antes, ya en Mesopotamia, y duró hasta, aproximadamente, el siglo XVIII.
Newton, que nació a medianos del siglo XVII, compaginaba sin problemas el estudio de la gravitación universal y las leyes de la mecánica, con la búsqueda de la piedra filosofal para transformar metales de baja ley en oro y plata. 150 años después, Dalton expuso su teoría atómica, y los pocos libros de hechizos que debían quedar abiertos se cerraron para siempre.
Dalton dijo que la materia está formada por átomos, igual que las piezas de un puzle crean una imagen, y describió cómo pensaba él que eran estos átomos. A partir de su modelo, se fueron desarrollando otros, hasta llegar al que tenemos hoy en día, que vendría a ser un bisnieto lejano del de Dalton.
Simplificando, podríamos decir que los átomos están formados por partículas subatómicas: protones, neutrones y electrones, que se distribuyen entre el núcleo (protones y neutrones) y su alrededor (electrones). Los protones tienen carga positiva, los neutrones no tienen carga y los electrones tienen carga negativa.
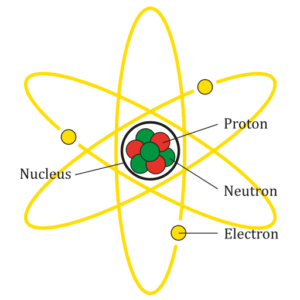
En general, un átomo tiene la misma cantidad de protones, de neutrones y de electrones -el Oxígeno, por ejemplo, tiene 8 protones, 8 neutrones y 8 electrones-, pero esto puede cambiar. Si cambiamos el número de electrones, tendremos un ion del elemento. Si ganamos electrones, será un ion con carga negativa, y si los perdemos, será un ion con carga positiva. El O-2 es un átomo de Oxígeno con 8 protones, 8 neutrones y 10 electrones. Los iones buscan interaccionar con iones de signo contrario para equilibrarse, y por eso se dice que son muy reactivos.
Si lo que modificamos es el número de protones, el átomo se transforma en otro elemento. ¡MAGIA! No es que los protones, electrones o neutrones que forman el átomo de oro sean distintos de los que forman el átomo de mercurio, sino que la diferencia está en cuántos protones tiene cada uno: 79 el átomo de oro, 80 el de mercurio. Alquimistas del mundo, lo que tenéis que hacer es robarle un protón al mercurio y ¡conseguiréis oro!
Finalmente, si cambiamos el número de neutrones, tendremos un isótopo distinto del elemento. El uranio-235, por ejemplo, tiene 92 protones y 143 neutrones (92+143=235, y de ahí el nombre). Como los neutrones no tienen carga, los isótopos nos son ni positivos ni negativos, pero al sufrir un desbalance entre el número de neutrones y de protones, pueden ser inestables.
Los isótopos inestables liberan partículas y energía para convertirse en un átomo estable, en un proceso llamado ‘decaimiento’. Este nuevo átomo resultante puede ser un átomo de otro elemento o un isótopo estable del mismo elemento que teníamos. La energía y las partículas liberadas son la radioactividad.
Henri Becquerel estaba un día estudiando unas sales de uranio y observó que, si las colocaba encima de papel fotográfico, el papel se velaba como si hubiera estado expuesto a la luz. Entendió que las sales emitían unos rayos y dejó que Marie y Pierre Curie siguieran investigando el asunto. En 1903 los tres ganaron el Premio Nobel de Física por haber descubierto la radioactividad.

Las centrales nucleares utilizan este fenómeno para obtener energía. Bombardean con protones una mezcla de uranio-235 y uranio-238, y provocan artificialmente que el uranio-235 se rompa. Se libera una gran cantidad de calor que, a través de turbinas y generadores, se transforma en electricidad.
Se usa una mezcla de los dos isótopos, y no uranio-235 puro, porque en la naturaleza se encuentran mezclados. A través de diversos procesos llamados ‘enriquecimiento del uranio’ se busca aumentar la proporción de uranio-235, pero la mezcla final no suele tener más de un 5% de este isótopo. Las cantidades ingentes de uranio-238 que no reaccionan son un residuo que se almacena por los siglos de los siglos.
La tesis que está haciendo Laura en la Universidad de Edimburgo consiste en intentar encontrar una función para este uranio-238. Principalmente, buscando si podría utilizarse para facilitar la transformación de monóxido y dióxido de carbono en otras sustancias, reduciendo así la concentración de estos gases contaminantes en la atmosfera. Sería una piedra filosofal muy útil para el planeta.
Post de Roser Bastida. Técnica de comunicación del Institut de Neurociències de la UAB (Barcelona). SRUK Friend.