Desafortunadamente, las listas de espera para trasplante de órganos aumentan cada año y no todos los pacientes llegan a recibir uno. Además, ¿quién no conoce a alguien que padezca de diabetes, enfermedades cardiacas, ceguera, etc.? Aunque estos pacientes no se encuentran en las listas de espera, su calidad de vida podría mejorar considerablemente gracias a un nuevo hígado, corazón o córneas.
¿Qué pensaríais si os dijera que la solución a este problema podría estar en producir órganos humanos en cerdos? Aunque parezca ciencia ficción, esta solución está un paso más cerca de la realidad gracias a un trabajo publicado este año por el científico español Juan Carlos Izpisúa Belmonte1.
Sin embargo, no es una tarea fácil. En primer lugar, es necesario producir quimeras. Según la mitología griega, “Quimera” era un monstruo con una cabeza de león, otra de cabra y una serpiente que nacía en la cola que vagaba por Asia Menor aterrorizando poblaciones. Pero hoy en día, llamamos quimera a un organismo que está compuesto por células de dos individuos diferentes. Los animales quiméricos se pueden producir en el laboratorio inyectando células madre de una especie en embriones muy tempranos de otra especie diferente.
Las células madre son capaces de dividirse indefinidamente, generando en cada división dos células hijas idénticas. Además, pueden formar cualquier tipo celular del cuerpo, así que en el laboratorio podemos hacerlas crecer y transformarlas en diferentes tejidos, aunque aún están lejos de poder fabricar un órgano completo que pueda ser utilizado para un trasplante. Sin embargo, al inyectarlas en un embrión pueden tener un entorno más favorable para ello.
Los primeros experimentos para este fin se llevaron a cabo en 20102 con embriones de ratón que previamente habían sido modificados genéticamente, eliminando genes necesarios para producir el páncreas. En principio, estos ratones serían incapaces de sobrevivir; sin embargo, al inyectar células madre de rata en cierto momento del desarrollo del embrión, los ratones pudieron desarrollarse y estar perfectamente sanos gracias a los órganos que produjeron las células madre de rata (Figura 1).
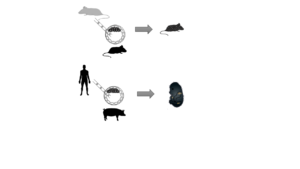
El siguiente paso fue tratar de encontrar un animal donde las células madre humanas fueran capaces de producir órganos. Los cerdos son similares a nosotros en muchos aspectos; entre ellos en el tamaño y la fisiología de nuestros órganos, por lo que fueron buenos candidatos para el equipo del Dr. Izpisúa Belmonte. Además, gracias a la reprogramación de células adultas (reconvertir células ya diferenciadas de nuevo en células madres) podemos obtener células madre específicas de cada paciente tan sólo a partir de una muestra de piel. Estas células pueden ser modificadas para que muestren una proteína verde fluorescente en todo momento. Así, utilizando luz ultravioleta podemos diferenciar fácilmente las células humanas (en verde) de las del cerdo (sin fluorescencia). Sin embargo, al introducir células madre humanas en embriones de cerdo, que fueron luego trasplantados a úteros de cerdas y recuperados 4 semanas más tarde (Figura 1), los investigadores descubrieron que sólo 1 de cada 100.000 células de estos fetos era de origen humano, por lo que la técnica aún no es muy eficiente. Para poder perfeccionarla, sería necesario saber en qué momento y en qué condiciones sería mejor introducir las células madre humanas en estos embriones, y para ello necesitamos tener un mayor conocimiento del desarrollo embrionario del cerdo.
El desarrollo embrionario antes de la implantación es fascinante. Después de que el espermatozoide fecunde el óvulo, este nuevo pequeño embrión comienza a dividirse y en esos primeros días sus células son capaces de convertirse en cualquier tejido. De hecho, estas células se pueden utilizar para obtener células madre en el laboratorio.
Hasta ahora, la mayoría de estudios sobre el desarrollo del embrión se han llevado a cabo en ratones por su facilidad de manejo (yo misma hice mi tesis doctoral con ratones). No obstante, su desarrollo es muy diferente al de los humanos. Por el contrario, el cerdo nos ofrece un modelo mucho más equiparable, a la vez que sostenible (Figura 2). Así que para mi aventura post-doctoral en Inglaterra decidí cambiar de especie y ahora me dedico a estudiar, en embriones tempranos de cerdo, cómo las células comienzan a tomar decisiones sobre “qué quieren ser de mayores” y qué mecanismos están implicados en ello. Para ello estamos analizando célula por célula todos los genes que son necesarios en cada momento del desarrollo. Esta técnica se conoce como “single-cell RNA sequencing” y ya ha sido utilizada recientemente en embriones humanos, de mono y de ratón.
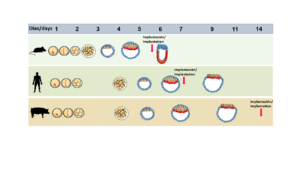
Los datos que generemos por primera vez en embriones de cerdo serán muy útiles para saber cuál es el mejor momento en el que introducir células madre humanas y en qué condiciones, para que puedan sobrevivir y formar parte del futuro animal. Además, nos permitirán estudiar momentos del desarrollo que no son accesibles en humanos debido a que el embrión está ya implantado en el útero materno, mientras que en el cerdo el embrión pasa casi una semana más creciendo en el útero antes de implantarse (Figura 2). Por todas estas razones, los embriones de cerdo son un modelo muy útil para estudiar momentos del desarrollo embrionario que son inaccesibles en humanos, y además podrían ayudar a mejorar la calidad de vida de muchas personas mediante la producción de “cerdos humanizados” para trasplante de órganos.
Por la Dr. Priscila Ramos Ibeas. Investigadora postdoctoral en la Universidad de Nottingham. Delegación de Midlands de CERU.
Más información:
Referencias:
- Wu, J. et al. Interspecies Chimerism with Mammalian Pluripotent Stem Cells. Cell 168, 473-486 e415 (2017).
- Kobayashi, T. et al. Generation of rat pancreas in mouse by interspecific blastocyst injection of pluripotent stem cells. Cell 142, 787-799 (2010).