Las enfermedades cardiovasculares representan una de las principales causas de mortalidad en las sociedades industrializadas. Además, un gran número de estas muertes están relacionadas con la generación de arritmias, las cuales son causadas por un funcionamiento eléctrico anormal del corazón [1]. Entre los principales factores que influyen en el desarrollo de arritmias, se encuentran la existencia de un tejido cardiaco con tendencia a la formación de arritmias, la presencia de un factor desencadenante y la modulación ejercida en el corazón por el sistema nervioso. Por esta razón, a la hora de comprender los mecanismos implicados en la generación de arritmias, un factor clave para mejorar el tratamiento clínico de los pacientes que las padecen es el estudio tanto de la electrofisiología cardiaca como del sistema nervioso autónomo.
La investigación clínica y experimental han sido tradicionalmente las metodologías utilizadas para aumentar el conocimiento relativo a las arritmias cardiacas. Sin embargo, en los últimos años, gracias al enorme progreso del rendimiento de los ordenadores, la simulación computacional se ha establecido como una nueva potente herramienta para ahondar en el conocimiento de los mecanismos que llevan al desarrollo de arritmias cardiacas. Gracias a la unión de la investigación clínica y a los experimentos centrados en la simulación de procesos biológicos por ordenador (formalmente conocidos como experimentos in silico), podemos desarrollar modelos computacionales que nos ayuden a desentrañar y mejorar la comprensión de los diferentes mecanismos vinculados con el riesgo arrítmico. Además, el uso de modelos computacionales nos permite llevar a cabo experimentos que no serían posibles de realizar en animales y personas, como la simulación del envejecimiento, el efecto de diferentes medicamentos o la presencia de diversas enfermedades.
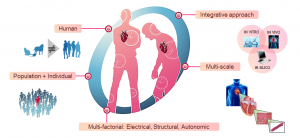
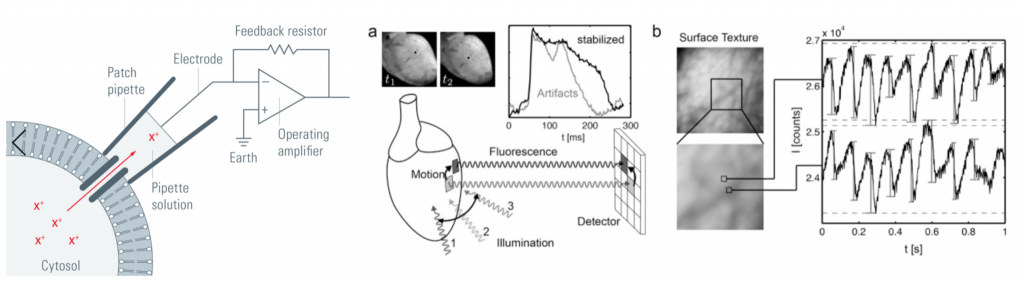
Por todo ello, en la investigación que estamos realizando dentro del grupo BSICoS (Biomedical Signal Interpretation and Computational Simulation), perteneciente a la Universidad de Zaragoza, buscamos combinar el conocimiento clínico y experimental sobre la electrofisiología cardiaca junto con métodos de simulación computacional para desarrollar modelos personalizados para cada paciente (Fig. 1). Estos modelos se implementan a partir de medidas de la actividad eléctrica de las células y tejidos cardiacos. Dichas medidas, denominadas señales de potencial de acción, son obtenidas a partir de técnicas como el patch-clamp (Fig. 2, izq.) o el optical mapping (Fig. 2, dcha.), las cuales nos permiten registrar el comportamiento eléctrico de las diferentes muestras y biopsias.
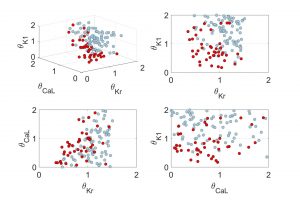
A partir de dichas señales eléctricas, y por medio de métodos matemáticos de estimación como el Unscented Kalman Filter y el Double Greedy Dimension Reduction [4], somos capaces de obtener una estimación del valor de diferentes parámetros y, con ello, implementar los diferentes modelos individualizados para cada corazón. En concreto, los parámetros que queremos incluir en estos modelos, los cuales acabarán determinando su comportamiento, son el número de canales iónicos de las diferentes tipologías (sodio, calcio, potasio) existentes en cada célula. Estos canales iónicos son las zonas de la membrana celular por las cuales dichos iones pasan del exterior al interior de las células (y viceversa), generando la actividad eléctrica y, a su vez, la contracción/relajación muscular que da lugar al latido del corazón. Este número de canales es distinto para cada zona del corazón y varía a lo largo de la vida, siendo distinto de un individuo a otro. Asimismo, ciertas enfermedades provocan el bloqueo de determinados canales iónicos dando lugar a peligrosas patologías. Por todo ello, predecir la cantidad de cada una de las tipologías de canales iónicos es de vital importancia. En consecuencia, los métodos matemáticos que utilizamos en nuestra investigación tienen la capacidad de estimar estos números de canales iónicos, permitiéndonos implementar los modelos individualizados que son capaces de reproducir computacionalmente las señales experimentales tanto en su morfología como en su variabilidad latido a latido. Gracias a la estimación de este número de canales iónicos podemos definir valores o combinaciones de valores que conlleven un mayor riesgo arrítmico (Fig. 4), pudiendo conocer de antemano el riesgo de desarrollar arritmias de cada paciente, adelantando así en el tiempo su propia terapia guiada individualizada. De este modo, gracias a estos modelos individualizados, podemos adecuar la terapia médica propuesta a cada individuo, así como también comprobar de antemano el correcto funcionamiento de la medicación prescrita.
En resumen, al igual que la tecnología ha llegado a nuestras casas y nuestros bolsillos para quedarse, también está llegando a nuestros corazones. Es importante que reconozcamos la importancia de todos los avances computacionales y tecnológicos, ya que gracias a ellos también podremos disfrutar de una vida más sana y larga. Así que la próxima vez que oigas que el corazón no tiene nada que ver con los ordenadores, podrás negarlo con certeza: son una pareja, extraña, pero pareja al fin y al cabo.
* * *
Por David Adolfo Sampedro Puente, investigador predoctoral en formación en la Universidad de Zaragoza.
Más información: