Cuando hablamos de la barrera intestinal, solemos pensar en el moco y en las células epiteliales que la forman. Aunque todo esto es cierto (ya hablamos de ello hace un tiempo), hay un componente menos conocido que, sin embargo, crucial: el glicocálix intestinal. Aunque el glicocálix no es un componente nuevo (se descubrió en 1969 [1]), solamente hace unos años pudimos saber cuál era su función in vitro (sobre el cual también hablamos en una entrada del blog de CERU).
Esta capa protectora, compuesta en gran parte por unas proteínas llamadas mucinas de membrana, recubre las células del intestino y actúa como una primera línea de defensa contra microorganismos y toxinas in vitro. De hecho, nuestro grupo de investigación descubrió que MUC17 es uno de los principales componentes del glicocálix intestinal, formándose durante la infancia cuando la microbiota coloniza nuestro tracto gastrointestinal.
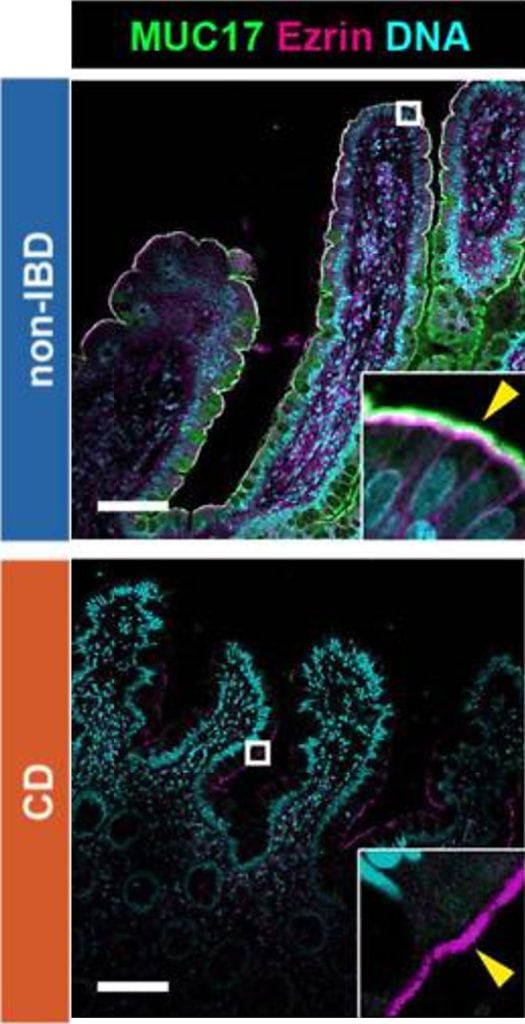
Imagen basada en Fig. 1 en Layunta et al. (2024).
No obstante… ¿Qué pasa cuando esta defensa se debilita? Nuestro nuevo hallazgo publicado en la revista científica Journal of Clinical Investigation Insight [2] ha demostrado que cuando hay menos MUC17 deja al intestino más expuesto a infecciones. Si esto no fuera poco, también vimos que la reducción de MUC17 podría estar relacionada con la enfermedad de Crohn, una afección inflamatoria intestinal crónica. En este nuevo estudio, hemos podido observar que los pacientes con enfermedad de Crohn presentan niveles reducidos de MUC17 (ver Figura 1).
En concreto, esto hace que las bacterias y las células epiteliales del intestino estén más cerca, lo que podría ser un factor clave en la progresión de la enfermedad. La enfermedad de Crohn es un trastorno inflamatorio que puede afectar cualquier parte del tubo digestivo, aunque suele localizarse en el intestino delgado. Su origen sigue sin estar claro, pero se sabe que ciertas alteraciones de la barrera intestinal facilitan la entrada de bacterias, esencadenando respuestas inmunitarias anómalas.
Para profundizar en el papel de MUC17, desarrollamos un modelo de ratón knockout condicional para el gen responsable de este componente del glicocálix intestinal: gen Muc17. En concreto, este tipo de ratones los modificamos genéticamente para «inactivar» el gen Muc17 en las células epiteliales intestinales: estos ratones no podrán generar MUC17, lo que les hace equiparables a pacientes con enfermedad de Crohn y nos permite investigar el rol del gen Muc17.
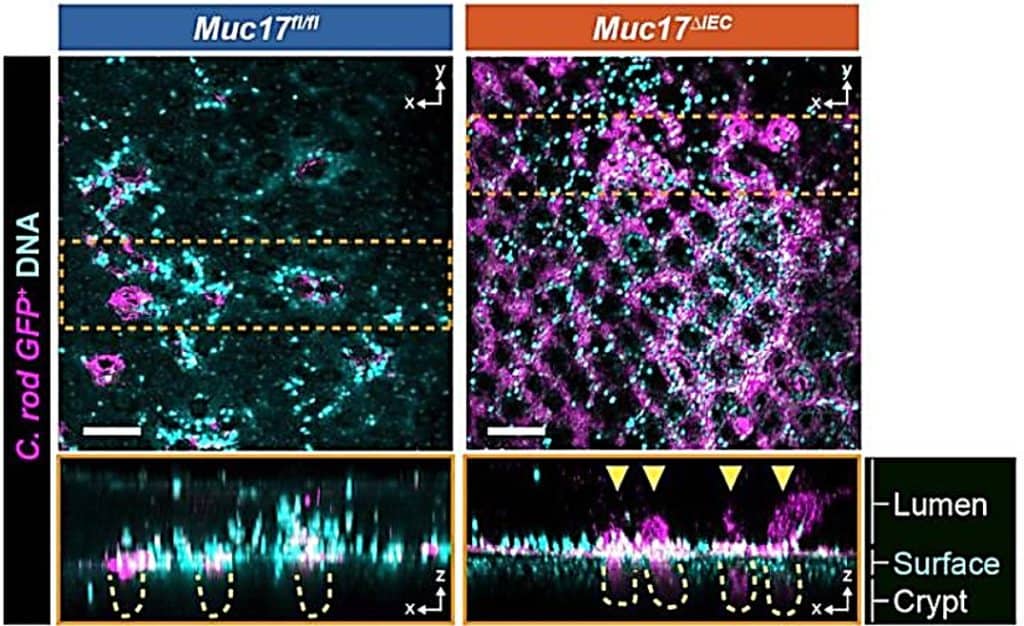
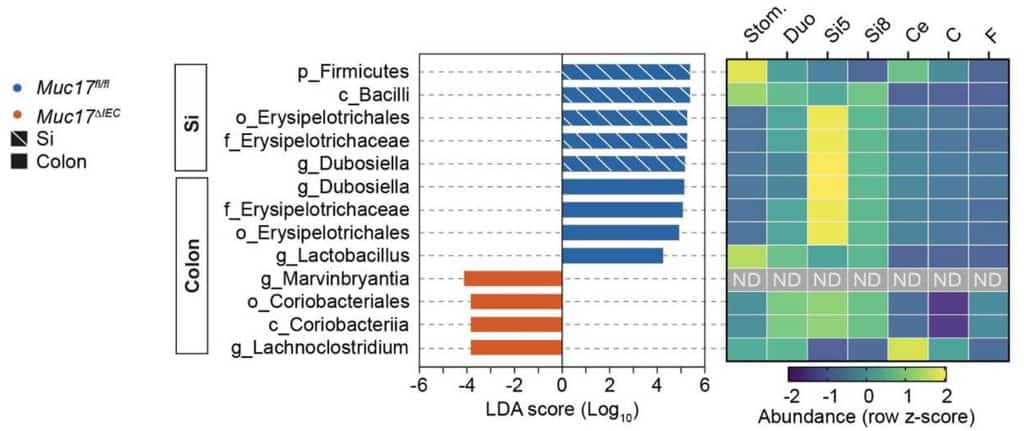
Los resultados fueron claros: estos ratones eran más vulnerables a infecciones intestinales atípicas (ver Figura 2), presentaban una alteración en la homeostasis epitelial e incluso presentaban una microbiota anómala (ver Figura 3). Consecuentemente, la ausencia de MUC17 parece que podría favorecer un ambiente propicio para la inflamación crónica, así como la enfermedad de Crohn.
Este hallazgo nos lleva a un punto de inflexión: si la ausencia de MUC17 puede alterar tanto la microbiota como la homeostasis intestinal, ¿podrían otros factores ambientales, como la dieta o el estrés, intensificar este problema? Los efectos de factores externos podrían entonces ser la clave para entender cómo ciertas personas desarrollan enfermedades intestinales, incluso cuando no tienen una predisposición genética. Y ahora viene la gran pregunta: ¿cómo podríamos reforzar esta barrera intestinal para prevenir este tipo de patologías gastrointestinales? Si la reducción de MUC17 contribuye a la disrupción de la barrera intestinal, una posible estrategia podría consistir en estimular su producción o estabilidad dentro de la propia barrera intestinal. En este sentido, IL-22 (una interleucina que ayuda en la reparación de tejidos dañados y reforzando las barreras naturales, como las del intestino, frente a infecciones [3]) podría ser una molécula interesante para futuras investigaciones, ya que está implicada en la formación del glicocálix de MUC17 en el intestino durante la infancia.
A día de hoy, sigue habiendo muchas preguntas en el aire. Algunas de ellas, son la siguientes: ¿qué otros factores pueden favorecer la formación y estabilidad del glicocálix intestinal? ¿Podría MUC17 convertirse en una nueva diana terapéutica para la enfermedad de Crohn y otras patologías gastrointestinales? Si MUC17 es la clave, ¿podríamos entrenar a nuestra microbiota para que nos ayude a mantener nuestra barrera intestinal en su mejor forma? Tal vez, algún día, la prevención de enfermedades intestinales comience desde el primer minuto de vida, supervisando de manera muy controlada la dieta y la colonización microbiana del intestino durante la infancia.
Cuando una puerta se cierra en tu investigación, suelen abrirse muchas más. Raramente se vive
lo suficiente para cerrar completamente un tema de investigación, siendo esto lo que nos lleva a continuar investigando. Hasta el último día de tu vida, ¡siempre puedes tener la ilusión de descubrir algo nuevo! Mientras el glicocálix siga revelando secretos sobre el funcionamiento del intestino, nosotros seguiremos de detectives. ¡Nos vemos en el próximo capítulo de este misterio!
Por Elena Layunta Hernández (@ELayunta). Profesora Ayudante Doctor en el Departamento de Anatomía, Embriología y Genética Animal | Facultad de Veterinaria | IUI Mixto Agroalimentario de Aragón (IA2) | Universidad de Zaragoza.
Más información:
- Ito S (1969).
- Layunta et al. (2024).
- Layunta et al. (2021).
- [Fuente en Inglés] Grupos de Mucinas. Fuente: University of Gothenburg. Disponbile online vía este enlace.
- [Fuente en Inglés] Grupos de Mucinas de Membrana. Fuente: Pelaseyed Lab. Disponbile online vía este enlace.